为了评估遗传学如何影响 PIBD 的发展,我们与同样来自 GWCMC 的 Yan Zhang 博士合作进行了全基因组关联研究 (GWAS)。
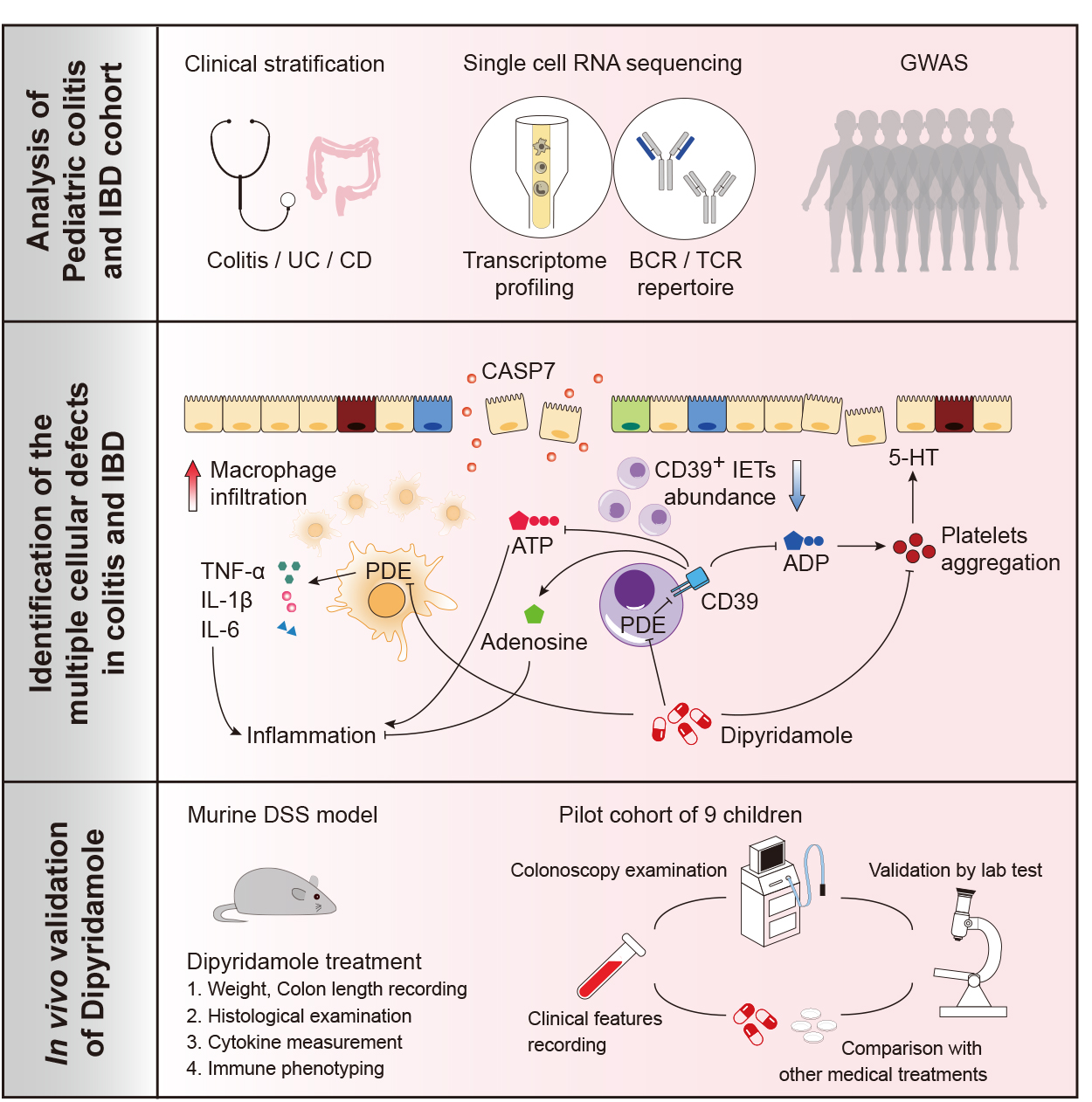
小儿发作性结肠炎和炎症性肠病 (IBD) 是许多婴儿、儿童及其监护人面临的重大挑战。疾病病因仍未完全了解,多达 50% 的儿童对常规治疗没有有效反应(JAMA Pediatr. 2015 Nov;169(11):1053-60. doi: 10.1001/jamapediatrics.2015.1982.)。与教授合作。来自北京大学的 Fan Bai,我们对结肠黏膜进行了 scRNA 测序和免疫分析,发现患有结肠炎或 IBD 的儿童缺乏表达 CD39 的上皮内 T 细胞 (CD39+ IET)。我们假设这种缺乏可能导致 ATP 和 ADP 的积累,随后分别通过巨噬细胞和血小板的激活加剧结肠炎症。事实上,血小板功能障碍在 IBD(炎症性肠病,2009 年 8 月;15(8):1245-55.doi:10.1002/ibd.20896.)或药物诱发的过敏反应(Sci Immunol. 2018 Apr 13;3(22). pii: eaan5997. doi: 10.1126/sciimmunol.aan5997.).
引人注目的是,生物信息学分析和功能验证已经确定多种免疫缺陷具有共同的潜在致病机制,即有缺陷的 cAMP 反应途径。这导致了直接从工作台到床的转换,并在由 GWCMC 胃肠病学系 Min Yang 博士领导的一项试点试验中证实,泛磷酸二酯酶抑制剂双嘧达莫可以恢复结肠免疫稳态(http:/ /www.chictr.org.cn/showprojen.aspx?proj=25986)。我们将继续探索双嘧达莫对 PIBD 亚型的治疗效果,确定可预测反应性的生物标志物,并测试其他特定的 PDE 抑制剂是否可能更有效地治疗 IBD。
评估遗传学如何影响 PIBD在开发过程中,我们与同样来自 GWCMC 的 Yan Zhang 博士合作进行了全基因组关联研究 (GWAS)。这已经确定了新的疾病风险基因,例如 DVL1、CASP7、PLEZO1,它们会影响结肠黏膜中的上皮细胞、成纤维细胞或免疫细胞的分化和功能。未来的研究将继续研究这些风险基因和致病基因(我们从患者及其父母的全外显子组测序中确定)如何增加儿童的疾病风险。
Yuxia Zhang
28 June 2021